- 中国では、過去に使用実績のある原料を基本的に使用可能としており、使用実績のない原料を「新原料」と呼びます。
- 禁止成分と新原料は使用できませんが、新原料は「新原料申請/登記」で認められれば使用可能になる可能性があります。
- 中国で使用実績のない原料(新原料):「2021年版 既使用化粧品原料目録」(8, 972収載)
- 新原料申請が可能な原料であるか、実行可能性に対して検討・報告を行う
- 製造企業が有する各種検査結果データ等の資料が登録要求を満たしているかに対して検討・報告を行う
- 新原料をNMPA局に申 請する業務。(資料作 成、中文翻訳等、申請 に必要となる業務一切 を含む)
- 新原料登録後から3年 間のサマリーレポート 提出義務期間における 対応
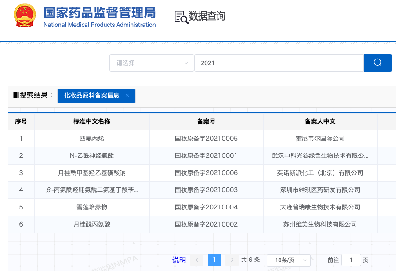
中国NMPA化粧品新原料申請 承認状況
新原料申請、承認の現状
- 5月23日現在、承認され、公開されている原料数:合計 154件
- 2021 年: 6 件
- 2022 年: 42 件
- 2023年: 69 件
- 2024年: 78 件

中国化粧品監督管理条例における新原料申請 関連法規定
第二章 原料と製品
- 第十一条
本国の領土内で初めて化粧品に使用する天然或いは人工の原料を化粧品新原料と言う。
防腐・紫外線保護・着色・染髪・シミ取り・美白効果を有する化粧品新原料は、国務院薬品監督管理部門を通じて登録完了後に使用することができる;その他の化粧品新原料は、使用前に国務院薬品監督管理部門に対し備案をしなければならない。
国務院薬品監督管理部門は科学研究の発展に基づき、登録管理をおこなう化粧品新原料の範囲を調整し、国務院の承認後にそれを実施することができる。 - 第十二条
化粧品新原料の登録を申請する或いは化粧品新原料の備案をおこなう際には以下の資料を提出しなければならない:- 登録申請者・備案者の氏名・住所・連絡先;
- 新原料の研究開発報告;
- 新原料の製造準備工程・安定性及びその品質管理基準等の研究資料;
- 新原料の安全性評価資料。
- 登録申請者・備案者は提出資料の真実性・科学性に対し責任を負わなければならない。
- 第十三条
国務院薬品監督管理部門は化粧品新原料登録申請を受理した日から起算して3営業日以内に申請資料を技術審査機構に渡さなければならない。
技術審査機構は申請資料を受け取った日から起算して90営業日以内に技術審査を完了し、国務院薬品監督管理部門に対し審査意見を提出しなければならない。国務院薬品監督管理部門は審査意見を受け取った日から起算して20営業日以内に決定をしなければならない。要件に合致しているものに対しては、登録をおこなった上で化粧品新原料登録証を発行する;要件に合致していないものに対しては登録をおこなわず書面による理由の説明をおこなう。化粧品新原料の備案者が国務院薬品監督管理部門のオンライン政務サービスプラットフォームを通じて本条例に規定される備案資料を提出すると備案は即時完了する。
国務院薬品監督管理部門は、化粧品新原料の承認・登録の日、或いは備案者が備案資料を提出した日より起算して5営業日以内に登録・備案に関する情報を公表しなければならない。 - 第十四条
登録・備案を経て化粧品新原料の使用を開始して以降3年間は毎年、新原料登録者・備案者は国務院薬品監督管理部門に対し新原料の使用及び安全状況について報告をしなければならない。
安全上の問題が存在する化粧品新原料に対しては、国務院薬品監督管理部門が登録或いは備案の取消しをおこなう。
3年の期間が満了するまで安全上の問題が発生していない化粧品新原料については、国務院薬品監督管理部門が制定する既使用化粧品原料のリストに追加される。
登録・備案を経た化粧品新原料が既使用化粧品原料のリストに追加される迄は、依然として化粧品新原料の規定に基づき管理される。 - 第十五条
化粧品の生産に用いることが禁止されている原料のリストは国務院薬品監督管理部門により制定・公布される。
新原料の分類と必要書類・試験項目について
手続きを行う新原料が以下「状況1〜6」のいずれに該当するかによって、必要な書類と試験項目が変わります。
| 状況分類 資料要求 | 状況1 | 状況2 | 状況3 | 状況4 | 状況5 | 状況6 | |
| 1.基本情報 | 1.登録または登録申請原料情報表 | ○ | ○ | ○ | ○ | ○ | ○ |
| 2.研究開発報告 | 2.研究開発背景 | ○ | ○ | ○ | ○ | ○ | ○ |
| 3.原料基本情報 | ○ | ○ | ○ | ○ | ○ | ○ | |
| 4.原料使用情報① | ○ | ○ | ○ | ○ | ○ | ○ | |
| 5.効能根拠資料 | ○ | ○ | ○ | ○ | ○ | ○ | |
| 6.研究関連のその他資料 | ○ | ○ | ○ | ○ | ○ | ○ | |
| 3.製造準備技術及び品質管理標準 | 7.製造工程技術概説 | ○ | ○ | ○ | ○ | ○ | ○ |
| 8.安定性試験資料 | ○ | ○ | ○ | ○ | ○ | ○ | |
| 9.品質規格指標及びその検証方法 | ○ | ○ | ○ | ○ | ○ | ○ | |
| 10.存在する可能性がある安全性リスク物質及びその管理などの資料② | |||||||
| 4.安全性評価 | 11.毒理学安全性評価概説 | ○ | ○ | ○ | ○ | ○ | ○ |
| 12.急性経口または急性経皮毒性試験③ | ○ | ○ | ○ | ○ | |||
| 13.皮膚及び眼刺激性/腐食性試験 | ○ | ○ | ○ | ○ | ○ | ○ | |
| 14.皮膚感作性試験 | ○ | ○ | ○ | ○ | ○ | ||
| 15.皮膚光毒性試験④ | |||||||
| 16.皮膚光感作性試験⑤ | |||||||
| 17.突然変異誘発試験 | ○ | ○ | ○ | ○ | |||
| 18反復.経口または経皮毒性試験 | ○ | ○ | ○ | ||||
| 19.変異性原性試験 | ○ | ||||||
| 20.慢性毒性/発がん性試験 | ○ | ||||||
| 21.吸収毒性試験⑥ | |||||||
| 22.長期人体試用安全試験 | ○ | ||||||
| 23.その他毒理学試験⑦ | |||||||
| 24.安全性評価報告 | ○ | ○ | ○ | ○ | ○ | ○ | |
| 5.他の資料 | 25.新原料技術要求26化粧品新原料登録申請に関するその他資料⑦ | ○ | ○ | ○ | ○ | ○ | ○ |
データ注釈及び記号の説明:
- 海外で使用履歴のある新原料は、原料が海外の化粧品に使用されている状況を説明する。
- 安全性リスク物質が存在する可能性のある新原料は当該項目のデータを提出する。
- 状況3に該当するもので、国際的に権威のある安全性評価機構の評価結論において化粧品中における使用が安全であると判断された安全性評価報告または倫理条件に適合する人体
- 安全性検査報告を提出できる新原料については、当該項目のデータを提出する必要はない。
- 原料が紫外線吸収特性を持つ場合、当該項目の試験結果データを提出する。
- 状況6に該当する新原料を除き、原料が紫外吸収特性を有する場合、当該項目の試験結果データを提出する。
- 原料が吸入暴露される可能性がある場合、当該項目のデータを提出する。
- 新原料の実際の状況に基づきその他のデータを提出する。
化粧品新原料状況分類の定義
登録・登記申請する新原料の効能、性状及び国内外化粧品における使用履歴、または食用履歴などに基づき、新原料は下記の6種の状況に分類される。新原料登録・登記申請者は申請する新原料の特徴に応じ、新原料が属する具体的な状況、及び対応する毒理学試験項目データを組み合わせる必要がある。
- 状況1
-
国内外で最初に使用される防腐・日焼け止め・着色・染毛・シミ取り美白・脱毛防止・ニキビ除去・抗シワ(物理的にシワ対策するものを除く)・フケ防止・消臭効能、及びその他の国内外で最初に使用される生物活性の高い化粧品の新原料については上記1~12項毒理学試験データを提出する必要がある。
- 状況2
-
国内外で最初に使用される防腐・日焼け止め・着色・染毛・シミ取り美白・脱毛防止・ニキビ除去・抗シワ(物理的にシワ対策をするものを除く)・フケ防止・消臭効能を持たない新原料は,上記の毒理学試験データを提出する。
- 状況3
-
防腐・日焼け止め・着色・染毛・シミ取り美白・脱毛防止・ニキビ除去・抗シワ(物理的にシワ対策をするものを除く)・フケ防止・消臭効能を持たない新原料で且つ十分な証拠として該当原料が海外で発売された化粧品中に三年以上の安全使用履歴があることを提出できる場合、上記1~6項の毒理学試験データを提出する。
同時に化粧品中に使用することが安全であると証明できる国際的な権威ある安全評価機構が認める安全判断報告書または倫理的条件下で人体安全性検証報告書を提出できる場合、急性経口または急性経皮毒性試験データの提出をする必要はない。 - 状況4
-
防腐・日焼け止め・着色・染毛・シミ取り美白・脱毛防止・ニキビ除去・抗シワ(物理的にシワ対策をするものを除く)・フケ防止・消臭効能を持ち、且つ十分な証拠で該当原料が海外で発売された化粧品中に三年以上の安全使用歴を提出できる場合、上記1~7項毒理学試験データを提出する必要がある。
- 状況5
-
安全食用履歴を持つ化粧品新原料(原料所用部位は食用部位と一致する)は、上記2~5までの毒理学試験データを提出し、併せて原料の暴露量、使用方法などに合わせ、原料にリスク評価を行う必要がある。
- 状況6
-
化学合成が一種または一種以上の構造単位で、共有結合により結合され、平均相対分子量が1000ダルトンより大きく、且つ相対分子量は1000ダルトンより小さい低重合体の含有量が10%より少なく、構造及び性質が安定した重合物(高い生物活性を持つ原料を除く)は上記第2及び第4項の毒理学試験データを提出する。
化粧品新原料申請のポイント
安全使用履歴関連資料要求
下記全ての条件を満たす場合、海外で発売された化粧品中に三年以上安全使用された履歴を持つ新原料と認める。 状況3と状況4に符合する新原料は同時に相応のデータを提出する。
- 新原料と海外で発売された化粧品中に使用された原料の品質、規格、使用目的、適用または使用範囲が同じであり、かつ新原料の安全使用量が海外で発売された化粧品中の使用量を超えない。
- 該当原料を含む化粧品の海外販売実績が三年以上になること。
- 該当原料を含む化粧品に該当原料が海外で使われたことを証明できる関連資料。
- 海外で発売された該当原料を含む化粧品が、該当原料により重大な有害事象または集団有害事象を引き起こした事がない。
- 該当原料により人体の健康が損なわれるといった文献報道がないこと。
安全食用履歴関連資料要求
下記条件の一つを満たす場合、安全食用履歴を持つ新原料と認める。 状況5に符合する新原料は同時に相応のデータを提出す。
- 中国関連監督管理部門食品安全認証を取得したまたはその他相応資質を有する食品用原料。
- 国内外関連監督管理部門、技術機構またはその他権威機構に認可された安全に食用される原料。
化粧品新原料安全監視年度報告作成要求
化粧品新原料登録・登記者は、新原料監視に関連する要求に応じて、新原料使用に関する情報を適時収集し、以下の要件に応じて新原料安全監視年度報告書を作成する。
- 原料基本情報
- 原料の生産状況
- 新原料を使用する化粧品の情報
- 新原料を使用する化粧品の監督、サンプリング検査、処理、回収状況
- 副作用監視報告
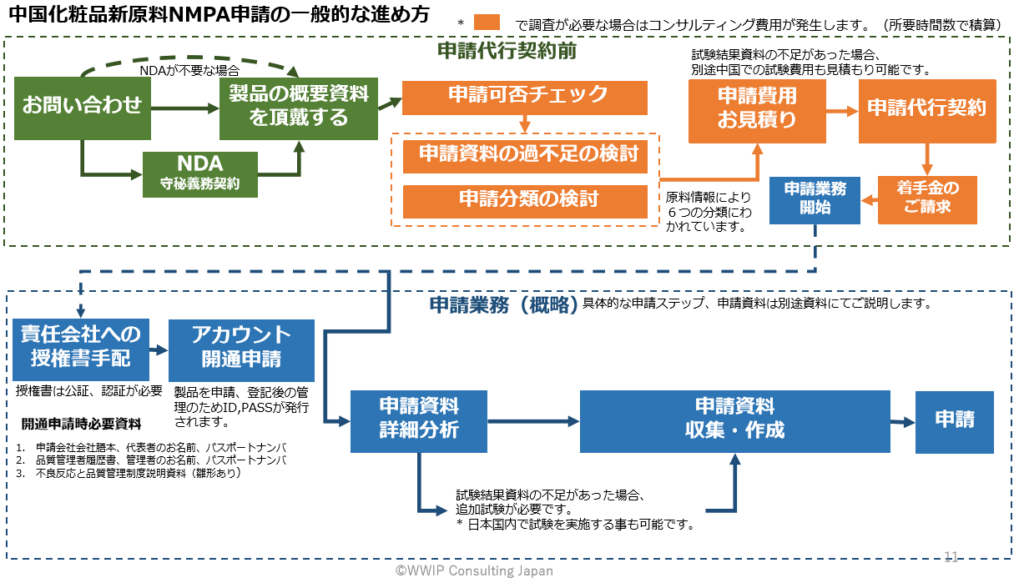
中国化粧品新原料NMPA申請の一般的な進め方
WWIPのサービス
申請をご希望の「成分INCI名」「化粧品への配合目的」をお知らせいただければ、前述「状況1〜6」のいずれに該当するか確認し、申請代行の見積もり金額をお知らせ致します。
まずはお気軽にお問合せください。
お気軽にお問い合わせください
お電話でお問い合わせは
03-6206-1723
有料動画視聴サービス:過去実施したセミナー動画を中心に有料動画を購入・視聴して頂けます。
有料データ販売:各国のレギュレーションに関するデータの原文、日本語翻訳を購入いただけます。





